[ad_1]
Las mitocondrias son conocidas como las ‘centrales energéticas’ de la célula porque producen la mayor parte de la energía en forma de ATP (nucleótido fundamental para la obtención de energía celular).
Sin embargo, en los últimos años se están desvelando otras funciones de las mitocondrias como ‘orgánulos de señalización’ esenciales para las células o el organismo; por ejemplo, el control de la proliferación o muerte de las células, la respuesta inmune o la adaptación a situaciones de estrés.
Estas funciones tienen lugar gracias a determinadas ‘señales’ que emanan de las mitocondrias para comunicarse con el resto de la célula o de los tejidos, para ejecutar respuestas coordinadas que permitan afrontar con éxito la adaptación a situaciones fisiológicas cambiantes.
Es por ello que la disfunción mitocondrial contribuye a un gran número de enfermedades y condiciones, desde patologías mitocondriales típicas a envejecimiento fisiológico de los organismos, cáncer, diabetes y enfermedades neurodegenerativas.
La inhibición de la enzima ATP sintasa en las mitocondrias neuronales promueve la producción de las especies reactivas de oxígeno necesarias para estimular la transmisión sináptica y consolidar la memoria. Así lo demuestra un trabajo publicado en PLoS Biology, liderado desde la Universidad Autónoma de Madrid (UAM).
Ahora, unos científicos de la Universidad Autónoma de Madrid (UAM) en España han demostrado (empleando modelos de ratón donde se ha anulado o incrementado la expresión del gen ATP5IF1 en neuronas) que aumentando la dosis de la proteína IF1 se inhibe aún más la enzima ATP sintasa mitocondrial, lo que promueve una mayor producción de las especies reactivas del oxígeno (ROS) que estimulan la transmisión sináptica y la memoria.
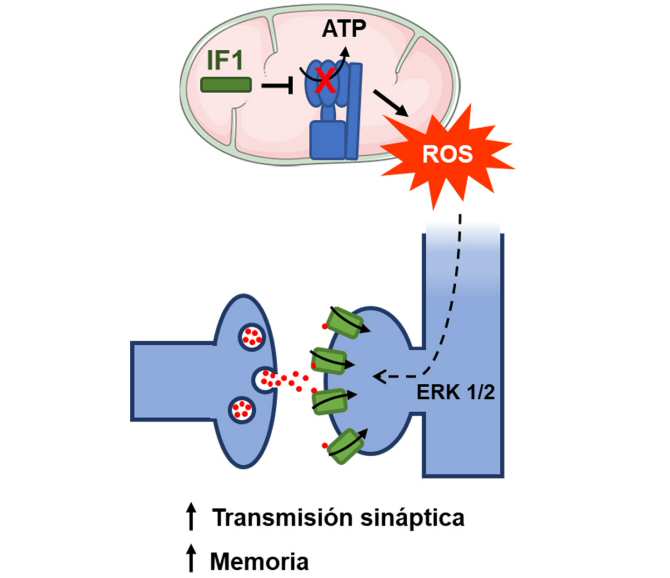
![[Img #64136]](https://noticiasdelaciencia.com/upload/images/06_2021/3044_nuevas-funciones-mitocondriales-en-la-memoria-humana.jpg)
IF1 (en verde) inhibe la actividad de la ATP sintasa mitocondrial (en azul), promoviendo la producción de especies reactivas del oxígeno (ROS) en las neuronas. La mayor producción de ROS estimula la transmisión sináptica entre neuronas principales del hipocampo al promover la activación de la quinasa ERK 1/2 (extracellular signal-regulated kinase 1/2) y favorece la memoria. (Imagen: UAM)
Estos resultados han sido publicados en la revista académica PLoS Biology, bajo el título “Generation of mitochondrial reactive oxygen species is controlled by ATPase inhibitory factor 1 and regulates cognition”.
Los resultados sientan las bases para profundizar en el papel que juega el eje IF1/ATP sintasa en funciones cerebrales complejas como el aprendizaje.
Lo descubierto permitirá además estudiar nuevas aproximaciones terapéuticas para tratar enfermedades que cursan con problemas cognitivos que tengan un componente mitocondrial.
El trabajo fue liderado por el grupo del profesor José M. Cuezva; grupo adscrito al Centro de Biología Molecular Severo Ochoa (CBMSO), al CIBER de Enfermedades Raras (CIBERER-ISCIII) y al Instituto de Investigación Hospital 12 de Octubre (i+12-UAM), y que contribuye a la comprensión de la actividad mitocondrial como central de señalización en memoria y aprendizaje.
La IF1 es una proteína que inhibe la actividad de la ATP sintasa, que es la principal enzima mitocondrial que produce ATP. Sin embargo, las neuronas del cerebro humano y de ratón son las células que tienen mayor contenido de la proteína IF1.
“Durante muchos años se ha pensado que IF1 solo es capaz de inhibir la actividad hidrolítica de la ATP sintasa en situaciones patológicas”, explica el Dr. Pau B. Esparza Moltó, investigador de la UAM y primer firmante del estudio.
“Sin embargo —agrega— con este trabajo, donde hemos generado los primeros ratones que carecen o sobreexpresan IF1 en neurona, hemos demostrado que IF1 juega un papel fundamental como regulador de la actividad de la ATP sintasa en condiciones fisiológicas y, por tanto, como regulador clave de la actividad mitocondrial y de la señalización por ROS”.
Junto a otros científicos del CBMSO, el Institut de Recerca Sant Joan de Déu de Barcelona y la Universidad de Cambridge (Reino Unido), el equipo se valió de un abordaje multidisciplinar para identificar los procesos celulares que están controlados por IF1.
Así, lograron demostrar que IF1 resulta clave para la transmisión sináptica y el aprendizaje, ya que su silenciamiento afecta a la memoria, mientras que la memoria y la transmisión sináptica se ven aumentadas con la sobreexpresión de IF1.
“Mostramos que la dosis de IF1 en neuronas controla la producción de ROS, y que las ROS regulan la memoria, al activar vías de señalización implicadas en la función sináptica”, detalla Esparza Moltó.
“En resumen, utilizando herramientas genéticas para regular la actividad de la ATP sintasa mitocondrial en neuronas in vivo, hemos descubierto que el eje IF1/ATP sintasa es clave para el control de la función mitocondrial, la actividad sináptica y la memoria”, concluye el investigador, que actualmente realiza una estancia postdoctoral en el Instituto Salk de California en Estados Unidos. (Fuente: UAM)
[ad_2]
Source link