[ad_1]
Las células tienen que adaptarse constantemente a su entorno para poder sobrevivir. Un aumento repentino en el medio de los niveles de osmolitos, como por ejemplo la sal, provoca que las células pierdan agua y se encojan. En cuestión de segundos, tienen que activar un mecanismo que les permita recuperar su volumen inicial de agua para no morir.
Averiguar qué genes están implicados en promover la supervivencia a un estrés osmótico ha sido el objetivo del estudio encabezado por los laboratorios del Dr. Posas y la Dra. De Nadal en el Instituto de Investigación Biomédica (IRB Barcelona) y el Dr. Valverde en la Universitat Pompeu Fabra (UPF) de Barcelona en colaboración con el grupo del Dr. Moffat de la Universidad de Toronto en Canadá. A partir de una criba genética de todo el genoma, determinaron que un gen llamado LRRC8A es el más importante para que una célula pueda sobrevivir a un choque osmótico.
Este gen codifica para una proteína que forma canales en la membrana que dejan salir iones de cloro hacia fuera de la célula. “Utilizando un modelo de célula epitelial humana, además de otros tipos celulares humanos y de ratón, hemos podido demostrar que este canal se abre poco después de exponer las células a una alta concentración de sal de cloruro de sodio (NaCl)”, explica la Dra. De Nadal, jefa del laboratorio de Señalización Celular del IRB Barcelona, junto con el Dr. Francesc Posas. El mecanismo molecular que provoca esta rápida apertura también ha sido identificado por los autores del estudio. El canal de cloro se fosforila, es decir, un grupo fosfato se añade a un aminoácido concreto de su secuencia, provocando la activación del canal.
“Nuestro proyecto ha sido complejo y ha tardado años en ver la luz” explica el Dr. Miguel Ángel Valverde, que lidera el laboratorio de Fisiología Molecular de la UPF, “hemos conseguido demostrar también cuán fundamental es que este canal se active y saque cloro para poner en marcha el proceso de recuperación del volumen y que las células puedan sobrevivir en el tiempo”, añade.
Utilizando una tinción violeta que tiñe solo las células vivas, los investigadores han podido ver que cuando bloquean la actividad de este canal de cloro con un compuesto específico las células mueren aproximadamente un 50% más.
![[Img #64189]](https://noticiasdelaciencia.com/upload/images/06_2021/4312_descubren-como-consiguen-las-celulas-sobrevivir.jpg)
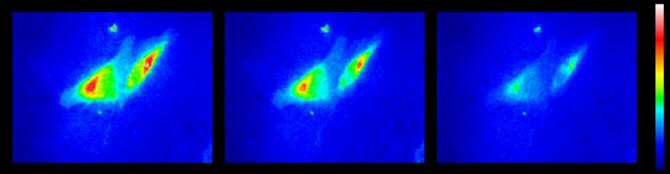
Imagen de microscopía de fluorescencia en la que se observan los cambios en las concentraciones de cloro en dos células a lo largo del tiempo utilizando una pseudoescala de color. (Imágenes: Universitat Pompeu Fabra / Institute for Research in Biomedicine / The Barcelona Institute of Science and Technology / University of Toronto)
Varios trabajos científicos clásicos sobre regulación del volumen celular ya habían descrito en los años 90 el proceso mediante el cual las células regulan su volumen para sobrevivir. Se sabía que las proteínas efectoras de recuperación del volumen bajo estrés salino requerían bajas concentraciones intracelulares de cloro para poder activarse, pero se desconocía cómo esto podía ser posible en unas condiciones tan adversas. Con este descubrimiento los autores del nuevo estudio han dado respuesta a una pregunta que muchos investigadores hacía años que se formulaban: ¿cómo sale el cloro para poner en marcha todo este proceso? En palabras de la coautora principal del estudio, la Dra. Selma Serra (UPF): “Ahora tenemos la respuesta a esta pregunta. Es el canal LRRC8A el que consigue disminuir los niveles de cloro de la célula. Hasta ahora conocíamos muy bien el papel de este canal para adaptar la célula a medios con muy bajas concentraciones de sales. El gran reto ha sido descubrir cómo podía ser que el mismo canal de cloro estuviera al frente del mecanismo opuesto. Al inicio de la investigación, escapaba de toda razón científica que un canal que sirve para deshinchar las células también las pudiera hinchar”.
Utilizando técnicas de electrofisiología y microscopía de fluorescencia en células vivas para detectar los niveles de cloruro intracelular, los investigadores han demostrado la implicación de la actividad del canal de cloro LRRC8A en respuesta a estímulos de alta salinidad.
Estudiar este proceso a nivel molecular ha supuesto un gran desafío para los investigadores de este trabajo. Uno de los motivos es que investigar in vivo células mientras sufren un choque osmótico y se encogen resulta muy complicado.
Otro factor importante es el hecho de que, bajo estas condiciones de estrés, el mecanismo para activar el canal de cloro es muy diferente del hasta ahora descrito en la literatura. El primer coautor del estudio, Predrag Stojakovic, explica: “Supuso una gran sorpresa descubrir que las vías de señalización en respuesta a estrés, las MAP quinasa, proteínas que estudiamos en el laboratorio hace años, son las responsables directas de la activación de este canal”. Las MAP quinasas son un grupo de proteínas señalizadoras que añaden grupos fosfato a otras proteínas y las activan o las inactivan. Utilizando técnicas moleculares, los autores han buscado por toda la proteína del canal cuál era la secuencia diana de estas proteínas quinasa. “Hemos sido capaces de identificar el residuo concreto del canal de cloro que hará que se active bajo el control de la vía de las MAP quinasa en respuesta a estrés”, subraya el estudiante de doctorado Stojakovic.
“Con esta nueva pieza de investigación abrimos nuevas posibilidades en el estudio de la adaptación y supervivencia de las células bajo estrés salino. Determinados órganos del cuerpo como por ejemplo los riñones a menudo se ven expuestos a entornos con altas concentraciones de sal que pueden amenazar su supervivencia. Conocer las moléculas que controlan la supervivencia en estas condiciones podría ser muy útil para entender ciertas patologías en las que la recuperación del volumen en respuesta a sales está implicada”, explica el Dr. Posas.
Por otro lado, el descubrir la implicación de este canal en estos procesos de regulación celular tiene importancia en muchas patologías en las cuales participan las proteínas que están controladas por LRRC8A. Y esto, tiene relevancia en situaciones como puede ser ciertos tipos de hipertensión arterial o isquemia cerebral.
El estudio se titula “LRRC8A-containing chloride channel is crucial for cell volume recovery and survival under hypertonic conditions”. Y se ha publicado en la revista académica PNAS (Proceedings of the National Academy of Sciences of the United States of America). (Fuente: IRB Barcelona)
[ad_2]
Source link